Conditions ICH

Un peu d’histoire
Le besoin d’harmonisation
Au cours des années 1960 et 1970, les industriels du secteur pharmaceutique ont pris conscience de la nécessité de procéder à une évaluation indépendante des médicaments avant leur mise sur le marché (sécurité, qualité et efficacité des nouveaux produits). A cette époque, l’industrie s’est internationalisée et recherchait à atteindre de nouveaux marchés. Cependant, les différences de normes entre pays étaient telles que l’industrie devait reproduire certains tests coûteux et chronophages afin de commercialiser de nouveaux produits à l’international.
Le besoin urgent de rationaliser et homogénéiser la réglementation de la production des médicaments a été accéléré par des inquiétudes liées au coût toujours plus important de la santé publique, aux investissements grandissants en R&D et au désir de satisfaire les attentes du public. En effet, un des enjeux était de produire de nouveaux médicaments à la fois efficaces et sûrs, et de les rendre disponibles le plus rapidement possible pour les patients en attente de traitement.
Le besoin urgent de rationaliser et homogénéiser la réglementation de la production des médicaments a été accéléré par des inquiétudes liées au coût toujours plus important de la santé publique, aux investissements grandissants en R&D et au désir de satisfaire les attentes du public. En effet, un des enjeux était de produire de nouveaux médicaments à la fois efficaces et sûrs, et de les rendre disponibles le plus rapidement possible pour les patients en attente de traitement.
La mise en route de l’ICH
Dans les années 1980, le développement d’un marché unique pour les produits pharmaceutiques a poussé la CEE à travailler sur l’harmonisation des dispositions réglementaires. Le succès rencontré en Europe démontra que l’harmonisation était possible. Au même moment, des discussions bilatérales ont été engagées entre l’Europe, le Japon et les Etats-Unis sur les possibilités d’homogénéisation. C’était cependant au cours de la conférence de l’OMS de 1989 à Paris sur les organismes de réglementation de médicaments que des actions concrètes ont commencé à prendre forme. Peu de temps après, ces organismes ont pris contact avec la Fédération Internationale de l’Industrie du Médicament (IFPMA en anglais) afin d’envisager un cadre commun réglementaire sur l’harmonisation internationale. Les premières pierres de l’ICH étaient ainsi posées.
La naissance de l’ICH a eu lieu en Avril 1990 à Bruxelles lors d’une réunion organisée par la Fédération Européenne des Industries et Associations Pharmaceutiques (EFPIA). Les représentants des organismes de réglementation européens, japonais et américains se sont réunis, dans un premier temps, pour envisager une conférence internationale, mais la réunion permit également d’évoquer les futures attributions et rôles de l’ICH.
Lors de la première réunion du comité directeur de l’ICH, il a été décidé que les thématiques retenues pour l’harmonisation seraient regroupées en Sécurité, Qualité et Efficacité afin de refléter les trois critères principaux évalués avant la mise sur le marché d’un nouveau produit.
La naissance de l’ICH a eu lieu en Avril 1990 à Bruxelles lors d’une réunion organisée par la Fédération Européenne des Industries et Associations Pharmaceutiques (EFPIA). Les représentants des organismes de réglementation européens, japonais et américains se sont réunis, dans un premier temps, pour envisager une conférence internationale, mais la réunion permit également d’évoquer les futures attributions et rôles de l’ICH.
Lors de la première réunion du comité directeur de l’ICH, il a été décidé que les thématiques retenues pour l’harmonisation seraient regroupées en Sécurité, Qualité et Efficacité afin de refléter les trois critères principaux évalués avant la mise sur le marché d’un nouveau produit.
La norme ICH
Principes des études de stabilité
Les études de stabilité permettent de récolter des données sur la façon dont varie la qualité des produits médicamenteux ou des substances médicamenteuses dans le temps et sous l’influence de divers facteurs environnementaux tels que la température, l’humidité ou la lumière. Les résultats définissent ainsi les périodes pour les contre-essais des substances médicamenteuses, la durée de vie des produits médicamenteux et leurs conditions de stockage.
Le choix des conditions expérimentales définies dans la présente ligne directrice est fondé sur une analyse des effets des conditions climatiques dans les trois régions (Europe, Japon et Etats-Unis). La température cinétique moyenne (MKT en anglais) dans n'importe quelle région du monde peut être dérivée des données climatiques. À ce titre, le monde est divisé en quatre zones climatiques (de I à IV). Le tableau ci-dessous s'applique aux zones climatiques I et II. Il est admis que les données de stabilité obtenue dans n'importe laquelle des trois régions représentées par la CE, le Japon ou les Etats-Unis soient acceptées dans chacune des deux autres, à condition que ces données respectent les exigences définies par la norme ICH et que l'étiquetage soit conforme aux normes nationales ou régionales.
Le choix des conditions expérimentales définies dans la présente ligne directrice est fondé sur une analyse des effets des conditions climatiques dans les trois régions (Europe, Japon et Etats-Unis). La température cinétique moyenne (MKT en anglais) dans n'importe quelle région du monde peut être dérivée des données climatiques. À ce titre, le monde est divisé en quatre zones climatiques (de I à IV). Le tableau ci-dessous s'applique aux zones climatiques I et II. Il est admis que les données de stabilité obtenue dans n'importe laquelle des trois régions représentées par la CE, le Japon ou les Etats-Unis soient acceptées dans chacune des deux autres, à condition que ces données respectent les exigences définies par la norme ICH et que l'étiquetage soit conforme aux normes nationales ou régionales.
Conditions de stockage
Généralement, un produit médicamenteux doit être testé dans les conditions de stockage (compte tenu des limites de tolérance appropriées) qui permettent d'évaluer sa stabilité à la chaleur et, éventuellement, à l'humidité. Les conditions de stockage et la durée des études doivent être suffisamment longues pour prendre en compte le stockage, l’expédition et l’utilisation ultérieure de la substance.
Les essais de longue durée doivent avoir lieu pendant une durée minimale de 12 mois sur au-moins trois des premiers lots au moment de la demande, et doivent se poursuivre sur une période suffisamment longue pour inclure la réalisation des contre-essais. Les données recueillies dans des conditions de dégradation accélérée et, quand c’est nécessaire, dans des conditions intermédiaires, peuvent servir à évaluer les effets d’un stockage de courte durée dans des conditions non prévues par la notice d’utilisation (comme cela peut être le cas durant le transport des produits).
Les conditions de stockage des substances médicamenteuses pour des essais de longue durée, de dégradation accélérée et, le cas échéant, à des conditions intermédiaires sont décrites dans le tableau ci-dessous. La partie « Cas général » s'applique si aucune des autres sections ne convient. D'autres conditions de stockage peuvent être utilisées si elles sont justifiées.
Les essais de longue durée doivent avoir lieu pendant une durée minimale de 12 mois sur au-moins trois des premiers lots au moment de la demande, et doivent se poursuivre sur une période suffisamment longue pour inclure la réalisation des contre-essais. Les données recueillies dans des conditions de dégradation accélérée et, quand c’est nécessaire, dans des conditions intermédiaires, peuvent servir à évaluer les effets d’un stockage de courte durée dans des conditions non prévues par la notice d’utilisation (comme cela peut être le cas durant le transport des produits).
Les conditions de stockage des substances médicamenteuses pour des essais de longue durée, de dégradation accélérée et, le cas échéant, à des conditions intermédiaires sont décrites dans le tableau ci-dessous. La partie « Cas général » s'applique si aucune des autres sections ne convient. D'autres conditions de stockage peuvent être utilisées si elles sont justifiées.
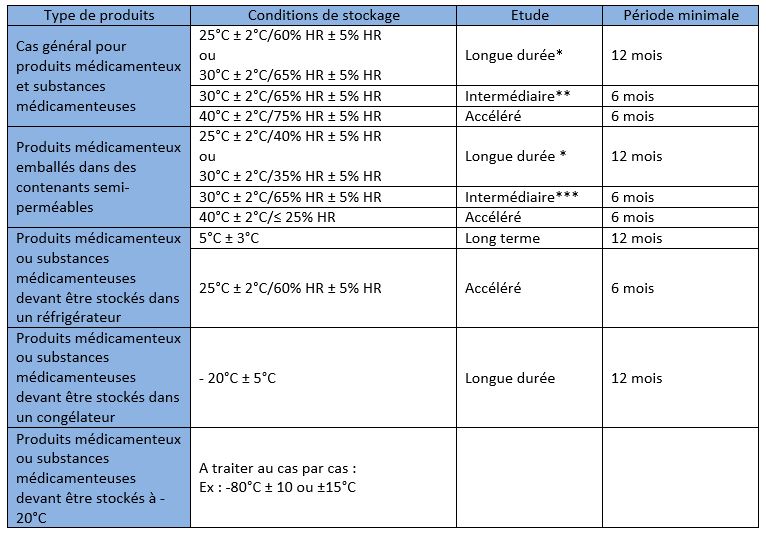
* L’utilisateur doit définir les conditions de stockage pour les études de longue durée.
** Si les conditions de longue durée sont de 30°C ± 2°C/65% RH ± 5% RH, il n’y aura pas de condition intermédiaire.
*** Si les conditions de longue durée sont de 30°C ± 2°C/35% RH ± 5% RH, il n’y aura pas de condition intermédiaire.
** Si les conditions de longue durée sont de 30°C ± 2°C/65% RH ± 5% RH, il n’y aura pas de condition intermédiaire.
*** Si les conditions de longue durée sont de 30°C ± 2°C/35% RH ± 5% RH, il n’y aura pas de condition intermédiaire.
Source : ICH official website
Choix de l’équipement climatique selon le type d’essai à réaliser
Les principaux critères à prendre en compte sont les suivants :
De plus, l’équipement choisi devra permettre de garder un bon équilibre entre :
- Le volume utile nécessaire
- Le nombre de rayonnages afin d’obtenir un stockage ordonné et une exposition adéquate aux conditions d'environnement souhaitées.
- La compatibilité de l’équipement avec les conditions d’utilisations souhaitées
- La durée des essais (favoriser un équipement polyvalent en cas de besoin de nombreuses conditions de stabilité)
- La mobilité de l’équipement
- Privilégier un équipement dont la maintenance peut être réalisée sans perturber l’environnement de stockage
De plus, l’équipement choisi devra permettre de garder un bon équilibre entre :
- Les performances maximales du besoin immédiat
- Les performances maximales des futures applications
- Le prix